Прямые потери в результате действия коррозии
Все потери в результате развития коррозии можно разделить на прямые и косвенные. Прямые потери прописываются как стоимость на повышение трудозатрат, ремонт, демонтаж и установку новых конструкций из металла.
Также к категории прямых затрат относится возникновение проблем с дополнительной обработкой металла после того, как на нем были замечены признаки коррозии. Организация защиты и борьба с последствиями электрохимической коррозии также требует серьезных затрат денег.
Также можно отнести к прямым потерям добавочные расходы. Они связаны с тем, что в местах с повышенным риском ржавения есть необходимость использования более дорогих материалов – защищенной стали, специальной коррозийной обработки.
Приходится тратиться на покупку ингибиторов для уменьшения воздействия коррозии, борьбу с потенциальными условиями, которые могли бы спровоцировать появление коррозии в помещении, где установлено стальное изделие.
О том, насколько серьезными оказываются прямые потери, говорит простая статистика. Она показывает, что в мире каждый год тратится до двух миллиардов долларов в год и это только в области дорожного строительства.
При этом ученые заявляют, что использование качественных мер защиты позволяет сократить потери на 15%. Одна из задач современной науки заключается в том, чтобы отыскать методы по дальнейшему уменьшению потенциальных прямых расходов.
6 Нюансы антикоррозионной защиты трубопроводов
Системы труб в настоящее время защищаются посредством дренажной и катодной электрохимической методики. При предохранении трубопроводов от коррозии по катодной схеме используются:
- Внешние источники тока. Их плюс подключат к анодному заземлению, а минус – к самой трубе.
- Аноды-защитники, использующие ток от гальванических пар.
Катодная методика предполагает поляризацию предохраняемой стальной поверхности. При этом осуществляется подключение подземных трубопроводов к «минусу» комплекса катодной защиты (по сути, он представляет собой источник тока). «Плюс» подключают к добавочному внешнему электроду при помощи специального кабеля, который изготавливается из проводящей резины или графита. Данная схема позволяет получать электроцепь замкнутого типа, включающую в себя следующие компоненты:
- электрод (наружный);
- электролит, находящийся в почве, где выполнена прокладка трубопроводов;
- непосредственно трубы;
- кабель (катодный);
- источник тока;
- кабель (анодный).
Для протекторной защиты трубопроводов применяют материалы на основе алюминий, магния и цинка, коэффициент полезного действия которых равняется 90 % при использовании протекторов на базе алюминия и цинка и 50 % для протекторов из магниевых сплавов и чистого магния.
Для дренажной защиты систем труб применяется технология отвода в грунт блуждающих токов. Существует четыре варианта дренажной антикоррозионной защиты трубопроводов – поляризованный, земляной, усиленный и прямой. При прямом и поляризованном дренаже между «минусом» блуждающих токов и трубой ставят перемычки. Для земляной защитной схемы необходимо произвести посредством добавочных электродов заземление. А при усиленном дренаже трубных систем в цепь добавляют преобразователь, который необходим для повышения величины дренажного тока.
https://youtube.com/watch?v=l_pU59HIdlo
Основные объекты коррозии
Неоднородные металлические участки хаотично расположены на поверхности изделия и зависят от технологии и качества их изготовления, поэтому коррозионные разрушения чаще носят локальный характер. Кроме этого, 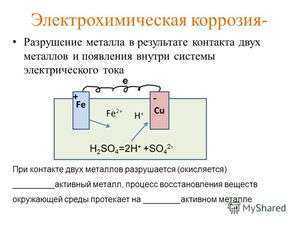 локальность корродирования зависит от неоднородности:
локальность корродирования зависит от неоднородности:
- защитных оксидных пленок;
- электролита;
- влияния внешних факторов (нагрева, облучения);
- внутренних напряжений, вызывающих неравномерную деформацию.
Сварные и заклепочные соединения являются яркими представителями контакта инородных металлов, подвергающихся активной электрохимической коррозии. Сварка и заклепка — самые распространенные технологии в конструкции неразъемных соединений во всех ведущих отраслях промышленности и крупных трубопроводных системах:
- машиностроение;
- судостроение;
- нефтепроводы;
- газопроводы;
- водопроводы.
Наиболее значительные разрушения сварных швов и заклепочных соединений возникают в морской воде, присутствие соли в которой, значительно ускоряет процесс коррозии.
Катастрофическая ситуация сложилась в 1967 году с рудовозом «Анатина», когда морская вода от высоких штормовых волн попала в трюмы корабля. Медные конструкции во внутренней отделке трюмов и стальной корпус способствовали созданию коррозионного элемента в электролите из морской воды. Скоротечная электрохимическая коррозия вызвала размягчение корпуса судна и создание аварийной ситуации, вплоть до эвакуации команды.
Положительный эффект от электрохимической коррозии встречается очень редко. Например, при монтаже новых труб в системах горячего отопления жилых домов. Резьбовые соединения муфт начинают течь при первичном пуске до тех пор, пока продукты коррозии, состоящие из гидратированного железа, не заполнят микропоры в резьбе.
Вне зависимости от вида коррозии, химической или электрохимической, ее последствия одинаковые — разрушение изделий огромной стоимости. Причем помимо прямых потерь от пришедших в негодность материалов, существуют косвенные потери, связанные с утечками продуктов, простоями при замене негодных материалов и деталей, нарушении регламентов технологических процессов.
Чем отличаются анодный и катодный процессы
Если вы внимательно проследите за тем, как работает гальванический элемент, то увидите, что в нем протекают сразу два связанных друг с другом процесса – анодный и катодный.
Рассмотрим их более подробно.
Анодный процесс
В химии показывается формулой Fe → Fe2+ + 2e. Она показывает, что постепенно запускается окисление, ионы металла начинают переход в раствор.
Катодный процесс
Может протекать по-разному.
В частности, переизбыток электронов решается ассимиляцией атомами электролита и его молекул. На фоне этого происходит восстановительная реакция непосредственно на самом катоде.
Формула будет зависеть от того, в каких условиях протекает реакция.
Так при наличии водородной деполяризации можно записать процесс как 2 H+ + 2e → H2.
Важно понимать, что оба процесса сильно связаны друг с другом под влиянием кинетического фактора. С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса
При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла
С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса. При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
Во время анализа протекания процесса коррозии часто обращают внимание на электропроводящие фазы и момент после их соприкосновения. Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный
Это приводит к появлению разности потенциалов
Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный. Это приводит к появлению разности потенциалов.
Таким образом возникает ДЭС или как его часто называют ученые – двойной электрический слой с ассиметричным расположением частиц в местах, где фазы разделяются.
Опасным для металла становится скачок потенциалов. Он может стимулироваться двумя центральными причинами:
- Большая накопленная энергия гидратации. В таком случае наблюдается отрыв ионов металла и постепенное перетекание их в раствор. На поверхности в результате остается аналогичное число электронов, заряд становится отрицательным. Далее, в соответствии с законами физики, наблюдается перетекание катионов из раствора, формируется ДЭС на границе, как мы уже описывали выше.
- Разряжение катионов электролита. В результате металл начинает стремительно принимать положительный заряд. ДЭС появляется из-за активности анионов раствора в контакте с катионами электролита.
Что происходит в том случае, если поверхностный слой металла совсем не имеет определенного заряда?
В таком случае ДЭС наблюдаться не будет, возникнет явление нулевого заряда.
Его потенциал будет отличаться в зависимости от того, с каким металлом вам приходится работать.
Описанный процесс значительно отражается на том, как протекает коррозия и как быстро она захватывает все новые и новые участки металла.
Если рассматривать вопросы, связанные с процессом поляризации, можно написать отдельную статью на эту тему.
Потому далее мы рассмотрим другой важный показатель – поляризацию.
Виды коррозийных процессов
Коррозия металлов имеет большое количество разновидностей. Но в основном все виды подразделяются на два основных типа:
- Коррозия общего характера. Она называется равномерной, а встречается чаще всего. Причиной возникновения такой коррозии считаются химические и электрохимические реакции. Такая разновидность коррозии приводит к отрицательному воздействию на всю поверхность материала и металлической конструкции. При этом процесс может быть равномерным или неравномерным. При неравномерном распределении ржавчины, она на одном участке разъедает материала быстрее и сильнее, чем на соседнем.
- Местный вид коррозии. Возникает на одном участке, где и развивается.
- Местная пятнами. Возникает на отдельных участках материала.
- Язвенная, ее еще называют питтинг.
- Межкристаллитная — такая коррозия возникает на пограничных областях металлического кристалла. Чаще вспыхивает в тех материалах, которые содержат в составе никель и алюминий. Металл в кратчайшие сроки остается без первоначальных показателей прочности и эластичности.
- Растрескивающая.
- Подповерхностная.
- Коррозия под током — возникает под воздействием блуждающего или постоянного тока.
- Коррозийная кавитация — вариант разрушений, когда помимо ржавчины на металл воздействует и ударная сила.
- Фреттинг-коррозия — одновременное воздействие ржавчины и вибрации, которые совместно приводят к разрушению металлических конструкций. варианты.

Есть еще различия и по механизму воздействия.
См.также: Самые дорогие металлы в мире
Химический вариант разрушения
Это разновидность процесса, при котором рушатся связи металлические, а между атомами веществ материала и окислителей возникает химическая взаимодействие. В такой ситуации не образуется электрический ток между различными областями материала. В свою очередь такой вид разрушения подразделяется еще на два типа:
- Газовый вариант. Получается при воздействии агрессивных азов, а также паров в сочетании с высокими показателями температуры. Если материал относится к активным, то воздействие таких сред может привести к окончательному разрушению материала по всей поверхности. К таким средам относятся: сероводород, диоксид серы, пары воды, кислород. Такой вид разрушительного процесса чаще всего заметен в промышленности и на химическом производстве.
- Жидкостный вариант ржавчины. Случается в неэлектролитических веществах. Если имеется даже небольшое содержание жидкости, то процесс становится электрохимическим.
Важно, что при химической разновидности коррозии металл разрушается со скоростью протекания химической реакции. См.также: Обработка металла давлением
См.также: Обработка металла давлением
Электрохимическая ржавчина
Этот вариант разрушительных процессов возникает в среде электролитов. Процесс сочетается с возникновением тока. В итоге из решетки вещества убирается атом и одновременно протекают два процесса:
- Анодный — вещество материала в качестве ионов входит в раствор.
- Катодный — те вещества, которые получаются в предыдущем процессе, связываются при помощи деполяризатора.
Собственно отвод электродов так и называется — деполяризация, а непосредственно вещества, которые способствуют данному процессу именуются деполяризаторами.
Наиболее часто возможно встретить вариант разрушения с водородной и кислородной деполяризацией.
Химическая коррозия
Химическая коррозия есть разновидность окислительно-восстановительной реакции, в которой металл выступает в роли восстановителя, а внешняя среда является окислителем, например, кислород, содержащийся в воздухе.
Многие металлы окисляются на воздухе:
4Al+3O2 = 2Al2O3
В результате окисления на поверхности металла образуется оксидная пленка, которая препятствует дальнейшему окислению. Такие пленки хорошо защищают от дальнейшей коррозии на воздухе цветные металлы (цинк, никель, алюминий), но не работают с железом, поскольку оксидная пленка получается пористой, и не защищает железо от дальнейшей реакции.
Химическая коррозия встречается не только при взаимодействии металлов с газами или жидкостями, не проводящими электрический ток. Коррозии подвергаются металлы при воздействии высоких температур в процессе обработки.
Что такое коррозия
Процесс разрушения верхнего слоя металлического материала под влиянием внешних воздействий называется коррозией в широком смысле.

Термин коррозия в данном случае – только характеристика того, что металлическая поверхность вступает в химическую реакцию и теряет под её влиянием свои изначальные свойства.
4 основных признака, по которым можно определить, что этот процесс существует:
- процесс, развивающийся на поверхности, и со временем проникающий внутрь металлического изделия;
- реакция возникает самопроизвольно от того, что нарушается устойчивость термодинамического баланса между окружающей средой и системой атомов в сплаве или монолите;
- химия воспринимает этот процесс не просто, как реакцию разрушения, но как реакцию восстановления и окисления: при вступлении в реакцию одни атомы замещают другие;
- свойства и особенности метала при такой реакции претерпевают значительные изменения, или утрачиваются там, где она происходит.
Рекомендации
Советы:
- На защите деталей лучше не экономить, и покрыть их резиновой или полимерной краской.
- Перед использованием абразивов нужно попробовать удалить ржавчину щадящими составами.
- Сложные коррозионные процессы можно останавливать с помощью агрессивных химикатов, но прежде чем их использовать, нужно изучить свойства состава, характеристики металла, чтобы предотвратить возможные негативные реакции.
Коррозионные процессы могут быстро разрушить любой материал. Порча металлоконструкций в некоторых ситуациях может иметь катастрофические последствия. Изучив способы защиты от образования коррозии, нужно применить один из наиболее подходящих.
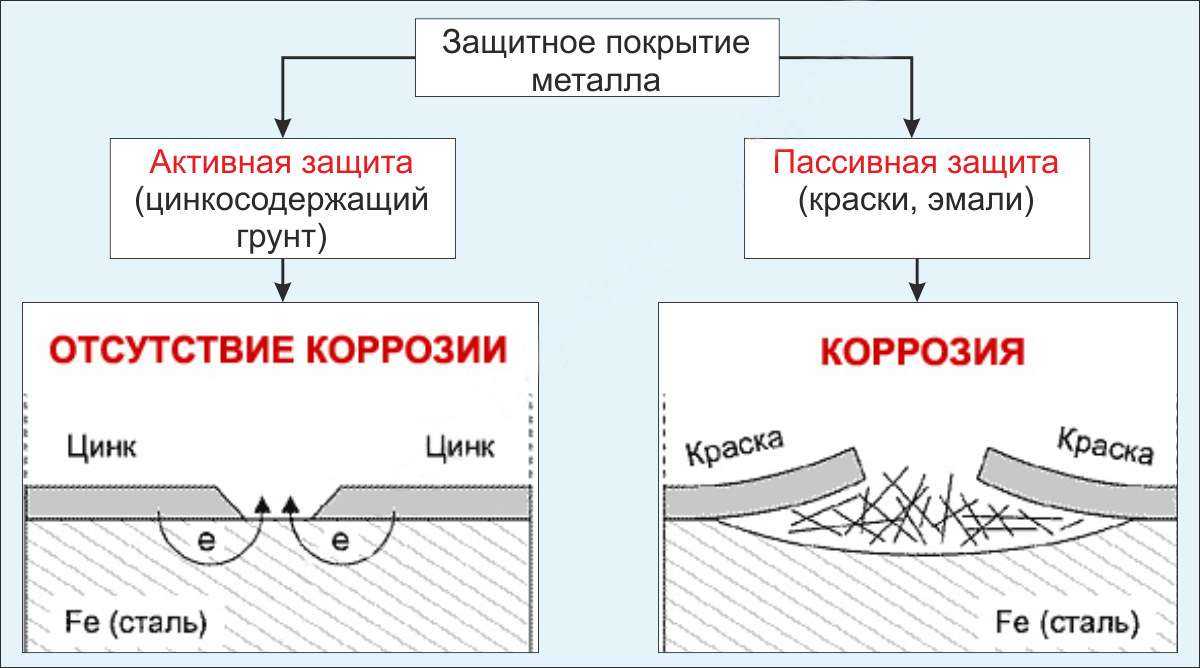
Активные и пассивные методы борьбы
Активные способы борьбы с коррозией действуют, изменяя структуру электрического поля. Для этого необходимо использовать постоянный ток. Напряжение должно быть таким, чтобы изделие имело повышенные характеристики. Довольно популярным методом будет использование “жертвенного” анода. Он защищает материал путем собственного разрушения. Условия коррозии металлов описаны выше.
Что касается пассивной защиты, то для этого используется лакокрасочное покрытие. Оно полностью защищает изделие от попадания жидкости, а также кислорода. Благодаря этому поверхность максимально защищена от разрушения. Следует использовать напыление из цинка, меди, никеля. Даже если слой будет сильно разрушен, он он все равно защитит металл от ржавения. Конечно, нужно понимать, что пассивные методы защиты будут актуальными только в том случае, если поверхность не имеет трещины или сколы.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия защищают металлическую поверхность от контакта с окислителями.
- Катодное покрытие – покрытие с менее активным металлом (металл защищает только неповрежденное покрытие). Покрытие красками, лаками, смазками. Формирование твердого оксидного слоя на поверхности некоторых металлов химическим методом (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут значительно отличаться от свойств чистых металлов. Добавление некоторых металлов может улучшить коррозионную стойкость сплава. Например, нержавеющая сталь, новые сплавы с высокой коррозионной стойкостью.
Изменение состава среды
Коррозия замедляется, когда ингибиторы коррозии добавляются в среду, окружающую металлическую конструкцию. Ингибиторы коррозии – это вещества, подавляющие коррозионные процессы.
Электрохимические методы защиты
Жертвенная защита: когда пластины более активного металла, протектора, прикрепляются к металлической конструкции. Протектор ухудшит протектор, а металлическая конструкция – нет.
Железная пластина в растворении солей меди
Из той же таблицы анодных индексов можно провести простой эксперимент. Растворение разумного количества (менее 10 граммов) CuSO45H2Или в воде ребенка просят окунуть в полированную железную пластину. Делается фотография, и процессу дают разворачиваться на пару недель.
Первоначально раствор имеет голубоватый оттенок, но начнет тускнеть, пока железная пластина станет медной. Это связано с тем, что медь более благородна, чем железо, и поэтому ее катионы Cu2+ будет восстановлен до металлической меди из ионов, полученных в результате окисления железа:
Вера => Вера2+ + 2e–
Cu2+ + 2e– => Cu
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
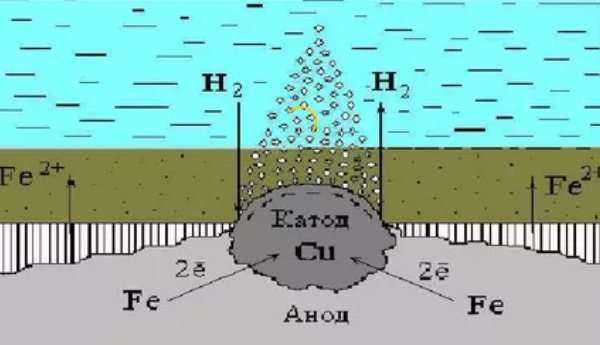
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов Категории Коррозия металлов, ОБЩАЯ ХИМИЯ
Современные методы борьбы
Многочисленные исследования и развитие технического прогресса привели к созданию целой системы методов и средств в борьбе с коррозией. Можно отметить три основных направления в защите от коррозии:
- Конструктивные решения.
- Активные методы.
- Пассивные методы.
Конструктивные решения состоят в выборе материалов, которые минимально поддаются коррозии по своим физическим свойствам:
- нержавеющие стали;
- легированные стали;
- цветные металлы.
Активные методы борьбы подсказала сама электрохимическая коррозия. Постоянное напряжение прикладывают к защищаемой металлической конструкции так, чтобы повысить его электродный потенциал и замедлить процесс электрохимического растворения. Второй вариант активной защиты — жертвенный анод, который имеет низкий электродный потенциал, вследствие чего разрушается вместо защищаемого объекта.
Пассивные методы состоят в нанесении защитных покрытий. Технический прогресс в этой области начал развиваться с нанесения простейших лакокрасочных покрытий, предотвращающих попадания кислорода, влаги и конденсата на поверхность металлов. Затем появились гальванические покрытия на основе:
- цинка — цинкование;
- хрома — хромирование;
- никеля — никелирование.
Оцинкованное железо, никелированные и хромированные столовые приборы, консервные банки с продуктами служат многие годы, не поддаваясь электрохимической коррозии, сохраняя красивый внешний вид, предохраняя порчу продуктов.
Примечания
- Антикоррозионная защита / Козлов Д.Ю.. — Екатеринбург: ООО «ИД «Оригами», 2013. — С. 343. — 440 с. — 1000 экз. — ISBN 978-5-904137-05-2.
- «ГОСТ 5272-68: Коррозия металлов. Термины.»
- Спиридонов А. А. В служеньи ремеслу и музам. — 2-е изд. — М.: Металлургия, 1989. — С. 53. — (Научно-популярная библиотека школьника). — 50 000 экз. — ISBN 5-229-00355-3.
- См. также, например, газеты «Ogden Standard Examiner», «Bridgeport Post» за 24 декабря 1967 года.
- ISO 8501-1. «Подготовка стальной основы перед нанесением красок и подобных покрытий. Визуальная оценка чистоты поверхности Часть 1. Степени окисления и степени подготовки непокрытой стальной основы и стальной основы после полного удаления прежних покрытий.»
- ГОСТ Р 9.316-2006 «Единая система защиты от коррозии и старения. Покрытия термодиффузионные цинковые. Общие требования и методы контроля.
- «Руководство для подготовки инспекторов по визуальному и измерительному контролю качества окрасочных работ» — Екатеринбург: ООО «ИД «Оригами», 2009—202 с., ISBN 978-5-9901098-1-5
- «Part Of Bridge On Route I-95 Falls Into River In Greenwich,; Killing 3.». New York Times. June 29, 1983. (англ.)
- (Июнь 2008) «ИЗ ИСТОРИИ КОРРОЗИИ». журнал «Очистка. Окраска» № 4 (15): 48. Проверено 2010-10-03.
Технический прогресс в развитии методов борьбы с коррозией
Так как коррозионные потери металла составляют астрономическую сумму, технический прогресс продолжает предлагать новые методы борьбы с ней, по мере развития научных исследований и совершенствования аппаратного обеспечения . К ним относятся:
. К ним относятся:
- газотермическое напыление, образующее сверхтонкие защитные покрытия;
- термодиффузионные покрытия, создающие прочную поверхностную защиту;
- кадмирование, обеспечивающее защиту стали в морской воде.
Рост промышленного производства происходит с постоянным увеличением выпуска металлических изделий. Электрохимическая коррозия, вне зависимости от исторической эпохи, представляет постоянную угрозу огромному объему конструкций и ответственных сооружений. Поэтому создание новых методов и средств борьбы — одна из задач исследований технического прогресса.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл. Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
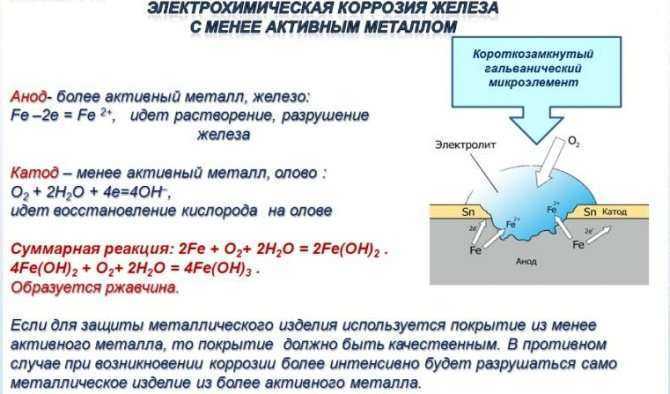
Причины и признаки электрохимической коррозии
Электрохимическая коррозия отличается от химической тем, что процесс разрушения проходит в системе электролитов, отчего внутри этой системы возникает электрический ток. Два сопряжённых процесса, анодный и катодный, приводят к удалению из кристаллической решетки металла неустойчивых атомов. Ионы при анодном переходят в раствор, а электроны от анодного процесса попадают в ловушку к веществу-окислителю и связываются деполяризатором.
Таким образом, деполяризация – это отвод с катодных участков свободных электронов, а деполяризатор – вещество, которое отвечает за этот процесс. Основные реакции происходят с участием водорода и кислорода в роли деполяризаторов.
Существует множество примеров электрохимической коррозии разного типа, которая оказывает воздействие на металлические поверхности в природе и проходит под влиянием различных условий. Водород при этом работает в кислой среде, а кислород – в нейтральной.
Практически все металлы подвергаются электрохимической коррозии, и по этому признаку их разбивают на 4 группы, определяют величину их электродного потенциала:
- активные коррозируют даже в той среде, где нет окислителей;
- среднеактивные вступают в реакцию окисления в кислотной среде;
- малоактивные не вступают в реакцию при отсутствии окислителей и в нейтральных, и в кислых средах;
- не вступают в реакцию — высокой стабильности (благородные металлы, палладий, золото, платина, иридий).
Но эта же реакция может протекать и в воде, в растворах оснований, солей и кислот. В узкоспециальном различии атмосферной коррозии различают почвенную и аэрационную, морскую и биологическую (протекающую под воздействием бактерий).
Есть даже электрическая коррозия, которая протекает под воздействием электрического тока, и является результатом работы блуждающих токов, возникающих там, где электрический ток используется человеком для осуществления определенной деятельности.
Гомогенная металлическая поверхность при этом разрушается из-за термодинамической неустойчивости к окружающей среде. А гетерогенная – из-за состава кристаллической решётки, в которой атомы одного металла держатся плотнее, чем атомы инородных вкраплений. Эти реакции отличаются скоростью протекания ионизации ионов, и восстановления окислительных компонентов окружающей среды.
Разрушение металлических поверхностей при электрохимической коррозии состоит в одновременном протекании двух процессов: анодного и катодного, и отличия процессов состоят в том, что растворение происходит на анодах, которые и контактируют с окружающей средой через множество микроэлектродов, которые входят в состав поверхности любого металла и замкнуты на себя.
Виды коррозии
В зависимости от типа металла и окислительно-восстановительной реакции, происходящей с ним, коррозия может быть:
- равномерной или неравномерной;
- местной и точечной (отдельные участки почему-либо вступили в реакцию, а другие – нет);
- язвенной, известной еще как питтинг;
- подповерхностной;
- растрескивающейся;
- межкристаллической, возникающая вдоль границ кристалла металла.
Также в зависимости от того, какие именно внешние факторы воздействуют на поверхность, коррозия бывает химической и электрохимической. Химическая коррозия происходит в результате некоторых реакций под влиянием химических взаимодействий, но без участия электрического тока, и может быть присуща даже нефти и газу. Электрохимическая отличается определенными процессами, она более сложная, чем химическая.
Статья по теме: Как предотвратить появление ржавчины на металле?

На видео: коррозия металлов.
Местная точечная коррозия в хлоридсодержащих средах
Точечная коррозия состоит в образовании небольших поражений, или точек, на поверхности материала. Обнаружить очаги коррозии можно при тщательном визуальном осмотре, однако они могут распространяться вглубь вплоть до образования сквозного отверстия в стенке трубы. Точечная коррозия чаще наблюдается в средах с высоким содержанием хлоридов при повышенных температурах.
Причины образования
При разрушении защитного слоя оксида (или пассивного оксидного слоя) на поверхности металлу свойственно терять электроны. Это приводит к следующему: железо в металле переходит в раствор с обладающим более анодными свойствами дном точки, а также окислению с образованием оксида железа или ржавчины. Концентрация раствора хлорида железа в точке может усиливаться по мере углубления выемки. Эти изменения ведут к ускоренному углублению точки, перфорации стенок трубок и возникновению утечек.
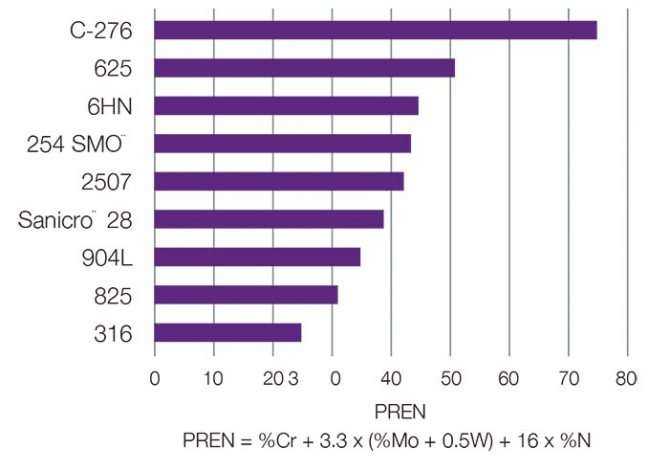
Более высокие значения PREN показывают более высокую стойкость материала к точечной коррозии. Лучший способ предотвращения точечной коррозии — правильный выбор сплава. Сравнение различных металлов и сплавов можно произвести с помощью числового эквивалента стойкости к точечной коррозии (Pitting Resistance Equivalence Number, PREN), который вычисляется на основе химического состава материала. Значение PREN возрастает по мере увеличения уровней содержания в материале хрома, молибдена и азота.