Причины появления коррозии
Когда встает вопрос о том, ржавеет ли алюминий, необходимо задуматься о причинах, приводящих к коррозии. Различные внешние факторы могут ускорять этот процесс. Причины появления ржавчины на алюминии могут быть следующими:
Взаимодействие с какой-либо кислотой или щелочью.
Механическое давление. Например, трение или сильный удар, после чего появляется царапина на верхнем слое металла.
Существуют промышленные районы. В них продукты распада топлива влияют на оксидную пленку и разрушают ее. Металл начинает портиться. Аналогичная ситуация происходит в мегаполисах, где продукты распада топлива будут взаимодействовать с серой, а также с оксидами углерода. Подобный процесс разрушает пленку на алюминии. После такого рода внешнего воздействия алюминий подвергается коррозии.
Следует помнить, что хлор, фтор, а также бром и натрий могут растворить защитный слой металла.
Если на металл попадают строительные смеси, то он начинает быстро портиться. В данном случае на алюминий неблагоприятно воздействует цемент.
Ржавеет ли алюминий от воды? Если она попадает на лист, то металл может быть подвержен коррозионным процессам. Важно при этом уточнить, какая жидкость оказывает воздействие. Многие используют специальный сплав, который не подвержен коррозии от воды. Его называют дюралюминием. Уникальный сплав используют вместе с медью, а также с марганцем.
Что такое электрохимическая коррозия и может ли она быть на листе алюминия?
Вам будет интересно:Что такое «патриции»? Исторические сведения
Чаще всего появление электрохимической коррозии провоцируют гальванические пары. Повреждение появляется в месте соединения двух разных сплавов. В таком случае ржавчина будет явно бросаться в глаза. Важным моментом является то, что портится только один металл, а второй является источником запуска коррозионного процесса. Чтобы не бояться электрохимической коррозии, нужно использовать магниевый сплав. Специалисты из-за электрохимической ржавчины не рекомендуют использовать обычное железо при контакте с кузовом из алюминия.

Особенности антикоррозионных составов
В местах скола краски видна ржавчина, а на осях покрытых смазкой коррозии нет
Что такое ингибиторы коррозии? Это такие вещества и элементы, которые, присутствуя в среде, подверженной опасному влиянию коррозии, в состоянии уменьшать и в целом останавливать коррозионное воздействие на металл. Ингибитор коррозии может представлять собой как одно химическое соединение, так и быть смесью многих.
Ингибиторами наиболее часто являются ПАВ вещества, а также всевозможная органика. При влиянии на изделие они еще сильнее улучшают защитные характеристики оксидной пленки на металле. По этой причине вы можете сделать вывод, что присутствие кислорода в среде благоприятствует подъему защитного эффекта от воздействия коррозии. Однако, если оксидная пленка имеет слабую устойчивость — ухудшается адсорбция ингибитора на верхнем слое металла.
- Ингибитор солеотложений ИОМС-1 (раствор)г 200 руб/кг. Макрофлекс.
- Ингибитор коррозии Protectogen(протектоген). C Aqua.
- Комплексонат – раствор цинкового комплекса. Эктоскейл.
- ГАЛАН. Протектор. Ингибитор коррозии (5 л). Защищает от коррозии трубопроводы, радиаторы и прочие системы отопления.
Как определить электрохимическую коррозию?
За редким исключением, коррозия формируется на поверхности металла, постепенно разрастаясь и проникая в глубокие слои. Существует несколько типов повреждений разной степени тяжести.
На рисунке показаны виды коррозионного разрушения:
- Сплошная. Покрывает всю поверхность изделия равномерным слоем. Возникает при полном контакте с электролитом, например, при нахождении изделия в растворе кислоты.
- Неравномерная. Коррозионная пленка покрывает всю поверхность изделия, но внутренние повреждения распространяются неравномерно.
- Пятна. Возникают в разных местах и не проникают на большую глубину.
- Язвы. Повреждения с глубоким проникновением. Распространение хаотичное.
- Точечная. Поражение на большую глубину. Сложный вид коррозии, так как на поверхности может выглядеть как обычное пятно, но при этом с очень глубоким проникновением.
- Межкристаллическая. Поражает кристаллическую решетку и в некоторых случаях не имеет выхода на поверхность.
- Растрескивающая. Коррозия, возникающая при одновременном контакте с электролитом, и при механическом воздействии на металл. Один из признаков старения механизмов и подвижных деталей.
Сплошная или равномерная коррозия наименее опасна в техническом плане. Она возникает по всей поверхности металла. Легко определяется на глаз и относительно просто поддается удалению. Более сложные процессы, особенно с глубоким проникновением остановить сложнее, а выявить зачастую невозможно без специальной экспертизы.
Электрохимическая коррозия – процесс неизбежный и необратимый. Однако, своевременное обнаружение позволяет принять меры по замедлению этого процесса.
Визуальное определение не дает полной картины происходящего. В частности оно не позволяет выявить кинетическую связь, то есть определить скорость протекания процесса. Для этого были разработаны различные меры контроля и преодоления коррозии:
- Металлография. Ряд методов, часть из которых позволяет проводить анализ без необходимости изъятия образцов. Существуют металлографические методы для определения межкристаллитной коррозии, благодаря которым можно выявить склонность металла к разрушению, а также скорость процесса при определенных условиях эксплуатации.
- Химические методы позволяют определить целостность структуры кристаллической решетки. Их также довольно много, а самым распространенным является кипячение нержавеющих сталей в натриевом растворе. Анализируется сам раствор на процентное соотношение в нем атомов железа к атомам хрома.
- Механические испытания. В зависимости от эксплуатационного назначения исследуемого объекта применяют методы испытания на растяжение, прочность, изгиб, вязкость, а также прочность на выдерживание давления.
- Рентген. Один из наиболее точных методов определения электрохимической коррозии, но самый трудоемкий и затратный.
Выбор метода испытания зависит от многих факторов. В частности от опасности эксплуатации поврежденного металла. В бытовых условиях коррозия определяется визуально, и в большинстве случаев этого достаточно для понимания общей картины происходящего и необходимости принятия мер.
Возвращаясь к разговору о полотенцесушителях, отметим, что наиболее стойким материалом к возникновению электрохимической коррозии считается нержавеющая сталь марки AISI 304 (наиболее качественная). Но и она может со временем дать слабину и тогда вы заметите сначала небольшие темные пятна на поверхности, увеличивающиеся в размерах и в глубине со временем.
Характерным признаком коррозии является точка-отверстие на очищенной (механическим путем) поверхности, которая свидетельствует о том, что процесс поражения водой с электричеством проходит и внутри. Конечно, существуют и дополнительные способствующие составы, присутствующие в воде — это кислород, хлор, кальций, магний, а также высокая температура! Наиболее подверженными коррозии элементами полотенцесушителя являются сварные швы, на которых в последствие появляются свищи и подтеки.
Как вода воздействует на описываемый металл?
Коррозия алюминия в воде может наступить от повреждения верхнего слоя и защитной пленки. Высокая температура жидкости способствует скорейшему разрушению металла. Если алюминий поместить в пресную воду, то коррозионные процессы практически не будут наблюдаться. Если повысить температуру воды, то изменений можно не заметить. Когда жидкость нагревается до температуры 80 градусов и выше, то металл начинает портиться.
Скорость коррозии алюминия увеличивается, если в воду попадает щелочь. Описываемый металл обладает повышенной чувствительностью к соли. Именно поэтому морская вода для него губительна. Чтобы использовать этот металл в морской воде, необходимо в жидкость добавлять магний или кремний. Если использовать лист алюминия, в составе которого есть медь, то коррозия сплава будет протекать гораздо быстрее, чем у чистого вещества.
2.3 Коррозия меди и её сплавов
Стандартный электродный потенциал меди 0 Cu 2+ /Cu =+0,34 B и 0 Cu + /Cu =+0,52 B. В 3 %-ном растворе NaCl и 1Н растворе HCl электродный потенциал меди также больше нуля и равен соответственно Cu =+0,06 B и Сu =+0,15 В. Поэтому медь может корродировать только с кислородной деполяризацией, и в раствор электролита переходят катионы Cu 2+ . При взаимодействии первичных продуктов коррозии катионов Cu 2+ и анионов ОН образуется труднорастворимый гидроксид меди (II), который может превращаться в оксид меди (II). В присутствии сероводорода образуется также CuS, углекислого газа ─ (CuOH)2CO3, сернистого газа ─ СuSO4 *Сu(OH)2.
Скорость коррозии Cu контролируется скоростью катодного процесса.
С увеличением и уменьшением рН раствора электролита скорость коррозии меди возрастает, что связано с амфотерным характером гидроксида меди (II).
Медь корродирует с большой скоростью только в присутствии кислорода в аммиачных и цианистых растворах с образованием комплексных ионов [Cu(NH3)4] 2+ и [Cu(CN)4] .
В воде и нейтральных растворах, не содержащих соединений, которые с катионами меди образуют комплексные ионы, медь обладает высокой коррозионной стойкостью.
В атмосферных условиях высокая коррозионная стойкость меди связана с образованием на её поверхности защитных плёнок, состоящих из продуктов коррозии, ─ Cu(OH)2 · CuCO3. В присутствии сернистого газа образуется плёнка CuSO4 · 3Cu(OH)2, не обладающая защитными свойствами, в результате коррозия меди значительно усиливается.
Медь устойчива в неокислительных соляной и серной (разбавленной) кислотах в отсутствии кислорода, а в присутствии его подвергается коррозии с кислородной деполяризацией. При этом в растворе H2SO4 в результате анодного процесса образуются катионы Cu 2+ , а в соляной кислоте ─ комплексные анионы [СuCl4] . Поэтому скорость коррозии в аэрированном растворе HCl больше, чем в растворе H2SO4.
В окислительных азотной и концентрированной серной кислотах медь легко растворяется с восстановлением разбавленной азотной кислоты до оксида азота (II) и концентрированной ─ до оксида азота (IV), а серной кислоты ─ до диоксида серы.
Сплавы Cu─Sn, Cu─Al и др. называют бронзами, системы Cu─Zn ─ латуни, сплав Cu─Ni ─ мельхиор.
Оловянистые бронзы содержат 8─10 % Sn и имеют более высокую коррозионную стойкость, чем чистая медь. Они хорошо сопротивляются действию серной и многих органических кислот.
Алюминиевые бронзы содержат до 10 % Al и обладают высокой коррозионной стойкостью в серной, разбавленной соляной, во многих органических кислотах, в морской воде и атмосферных условиях.
В латунях количество Zn может достигать 50 %. Они по коррозионной стойкости занимают промежуточное положение между медью и цинком. Характерные виды коррозии латуней ─ обесцинкование и коррозионное растрескивание.
Обесцинкованию подвергаются латуни, содержашие более 15 % Zn. Введение небольших количеств олова (примерно 1 %) и сотых до-лей процента мышьяка (As) повышает сопротивление латуней обесцинкованию.
Коррозионная стойкость латуней повышается при легировании их Sn, Ni и Al. При содержании около 1 % Sn «адмиралтейская латунь» обладает высокой коррозионной стойкостью в морской воде. Ещё более высокой стойкостью в этой среде обладает мельхиор (80 % Cu и 20 % Ni).
Условия разрушения материала
Несмотря на устойчивость к порче, даже медные изделия при определенных условиях могут ржаветь. Меньше всего подобные явления выражены во влажном воздухе, воде, почве, больше – в кислой среде.
Серьезно снизить коррозию можно путем лужения – покрытия меди слоем олова. Качественное лужение дает надежную защиту от повреждений, повышает коррозионную стойкость, делает материал не подверженным действию высоких температур, дождя, града, снега. Срок службы луженых изделий составляет более 100 лет без потери первоначальных свойств.

Влияние воды
Скорость коррозии меди в воде сильно зависит от наличия оксидной пленки на ее поверхности, а также от степени насыщенности воды кислородом. Чем больше содержание последнего, тем интенсивнее протекает разрушение материала. В целом, медь считается стойкой к вредному воздействию соленой и пресной воды, и пагубно влияют на нее только растворенные ионы хлора, низкий уровень pH. Прочность, неподверженность ржавлению позволяет применять материал для изготовления трубопроводов.
В морской воде уровень коррозии практически такой же, как и в пресной. Лишь при ускорении движения жидкости коррозия становится ударной, поэтому – более интенсивной. Медь – материал, который не способен обрастать морскими микроорганизмами, ведь его ионы губительны для моллюсков, водорослей. Это свойство металла используется в судоходстве, рыбном хозяйстве.

Воздействие кислот и щелочей
В щелочах медь не портится, ведь материал сам по себе является щелочным, зато кислоты для нее являются самыми пагубными по воздействию. Наиболее значимая и быстрая коррозия происходит при контакте с серой и ее кислотными соединениями, а азотная кислота и вовсе полностью разрушает структуру материала.
В концентрированных кислотах медь растворяется, поэтому при изготовлении оборудования для нефтегазовой промышленности требует дополнительной защиты. С этой целью применяются ингибиторы – замедлители химических реакций:
- Экранирующие – формируют пленку, которая не позволяет кислотам достигать медной поверхности.
- Окислительные – превращают верхний слой в окись, которая будет вступать в реакцию с кислотами без вреда для самого металла.
- Катодные – увеличивают перенапряжение катодов, чем замедляют реакцию.
Коррозия в почве и влажном воздухе
В почве проживает множество микроорганизмов, которые вырабатывают сероводород, поэтому среда тут кислая, скорость коррозии меди возрастает. Чем более отклонено значение pH в сторону закисления, тем быстрее протекают процессы разрушения. Если грунт насыщен кислородом, металл окисляется, но ржавеет меньше. При длительном нахождении медных изделий в земле они зеленеют, становятся рыхлыми и могут даже рассыпаться. Краткосрочное пребывание в почве вызывает появление патины, от которой предмет можно очистить.
Коррозийные свойства
В связи с отсутствием у меди химической активности, при контакте с водой, влажным воздухом ее коррозия практически не возникает. Находясь в сухом воздухе, у металла может образовываться небольшая оксидная пленка толщиной до 50 нм. Если изделие лужено, то пленка почти не образовывается. Качественное покрытие из олова способно надежно защитить от влаги, перепадов температуры. При этом продолжительность эксплуатации такого предмета может составлять до 100 лет без потери первоначальных свойств. С течением времени цвет не будет изменяться. Применение луженных поверхностей давно показало себя с лучшей стороны. Примером могут стать купола множества храмов.
В связи с высоким порогом коррозийной стойкости медь активно применяется во многих химических и электрохимических производствах. К примеру, процесс обмеднения металла помогает решить множество задач при обработке. В одной из прошлых статей, мы рассматривали процедуру в домашних условиях, рекомендуем ознакомиться.
Виды коррозии
Как уже говорилось, критериев классификация коррозионных процессов существует множество. Так, различают коррозию по виду распространения (сплошная, местная), по типу коррозионной среды (газовая, атмосферная, жидкостная, почвенная), по характеру механических воздействий (коррозионное растрескивание, явление Фреттинга, кавитационная коррозия) и так далее.
Но основным способом классификации коррозии, позволяющим наиболее полно объяснить все тонкости этого процесса, является классификация по механизму протекания.
По этому критерию различают два вида коррозии:
- химическую
- электрохимическую
Химическая коррозия
Химическая коррозия отличается от электрохимической тем, что протекает в средах, не проводящих электрический ток. Поэтому при такой коррозии разрушение металла не сопровождается возникновением электрического тока в системе. Это обычное окислительно-восстановительное взаимодействие металла с окружающей средой.
Наиболее типичным примером химической коррозии является газовая коррозия. Газовую коррозию еще называют высокотемпературной, поскольку обычно она протекает при повышенных температурах, когда возможность конденсации влаги на поверхности металла полностью исключена. К такому виду коррозии можно отнести, например, коррозию элементов электронагревателей или сопел ракетных двигателей.
Скорость химической коррозии зависит от температуры — при ее повышении коррозия ускоряется. Из-за этого, например, в процессе производства металлического проката, во все стороны от раскаленной массы разлетаются огненные брызги. Это с поверхности металла скалываются частички окалины.
Окалина — типичный продукт химической коррозии, — оксид, возникающий в результате взаимодействия раскаленного металла с кислородом воздуха.
Помимо кислорода и другие газы могут обладать сильными агрессивными свойствами по отношению к металлам. К таким газам относятся диоксид серы, фтор, хлор, сероводород. Так, например, алюминий и его сплавы, а также стали с высоким содержанием хрома (нержавеющие стали) устойчивы в атмосфере, которая содержит в качестве основного агрессивного агента кислород. Но картина кардинально меняется, если в атмосфере присутствует хлор.
В документации к некоторым антикоррозионным препаратам химическую коррозию иногда называют «сухой», а электрохимическую — «мокрой». Однако химическая коррозия может протекать и в жидкостях. Только в отличие от электрохимической коррозии эти жидкости — неэлектролиты (т.е. не проводящие электрический ток, например спирт, бензол, бензин, керосин).
Примером такой коррозии является коррозия железных деталей двигателя автомобиля. Присутствующая в бензине в качестве примесей сера взаимодействует с поверхностью детали, образуя сульфид железа. Сульфид железа очень хрупок и легко отслаивается, освобождая свежую поверхность для дальнейшего взаимодействия с серой. И так, слой за слоем, деталь постепенно разрушается.
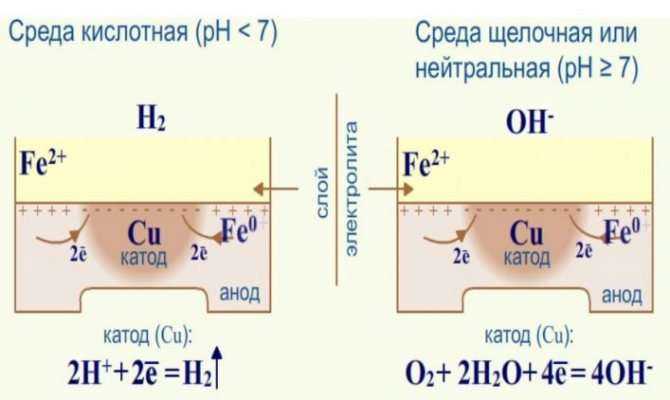
Электрохимическая коррозия
Если химическая коррозия представляет собой не что иное, как простое окисление металла, то электрохимическая — это разрушение за счет гальванических процессов.
В отличие от химической, электрохимическая коррозия протекает в средах с хорошей электропроводностью и сопровождается возникновением тока. Для «запуска» электрохимической коррозии необходимы два условия: гальваническая пара и электролит.
В роли электролита выступает влага на поверхности металла (конденсат, дождевая вода и т.д.). Что такое гальваническая пара? Чтобы понять это, вернемся к ряду активности металлов.
Смотрим. Cлева расположены более активные металлы, справа — менее активные.
Если в контакт вступают два металла с различной активностью, они образуют гальваническую пару, и в присутствии электролита между ними возникает поток электронов, перетекающих от анодных участков к катодным. При этом более активный металл, являющийся анодом гальванопары, начинает корродировать, в то время как менее активный коррозии не подвергается.
Схема гальванического элемента
Для наглядности рассмотрим несколько простых примеров.
Допустим, стальной болт закреплен медной гайкой. Что будет корродировать, железо или медь? Смотрим в ряд активности. Железо более активно (стоит левее), а значит именно оно будет разрушаться в месте соединения.
Стальной болт — медная гайка (корродирует сталь)
А если гайка алюминиевая? Снова смотрим в ряд активности. Здесь картина меняется: уже алюминий (Al), как более активный металл, будет терять электроны и разрушаться.
Таким образом, контакт более активного «левого» металла с менее активным «правым» усиливает коррозию первого.
Методы предохранения металла
Практически все металлы в газообразной или жидкой среде подвергаются поверхностному разрушению. Основным способом защиты меди от коррозии является нанесение на поверхность изделий защитного слоя, состоящего из:
- Металла – на медную поверхность изделия наносится слой металла, который более устойчив к коррозии. Например, в качестве него используют латунь, цинк, хром и никель. В этом случае контакт с окружающей средой и окисление будет происходить с металлом, используемым для покрытия. Если защитный слой частично портится, то происходит разрушение основного металла – меди.
- Неметаллических веществ – это неорганические покрытия, состоящие из стекловидной массы, цементного раствора, или органические – краски, лаки, битум.
- Химических пленок – защиту образуют химическим способом, создавая на поверхности металла соединения, надежно предохраняющие медь от коррозии. Для этого используют оксидные, фосфатные пленки или насыщают поверхность сплавов азотом, органическими веществами либо обрабатывают углеродом, соединения которого надежно сохраняют ее.
Кроме этого, в состав медных сплавов вводят легирующий компонент, который усиливает антикоррозийные свойства, или изменяют состав окружающей среды, удаляя из нее примеси и вводя ингибиторы, замедляющие протекание реакции.
Классификация питтинговой коррозии
Существует несколько видов питтинга:
- Поверхностный. При таком сценарии ржавчина затрагивает исключительно верхнюю поверхность металла. Распространяется она в виде небольших тонких линий диаметром 1-3 мм. Поверхностная ржавчина на начальном этапе обычно захватывает углы, однако со временем она начинает распространяется в горизонтальном направлении по всей поверхности металлического элемента.
- Открытый. При таком сценарии ржавчина распространяется в виде частых крупных точек, диаметр которых составляет 2-5 мм. На поверхности сперва образуется несколько точек, которые располагаются далеко друг от друга. Со временем количество точек пропорционально растет и они захватывают всею поверхность металлического объекта.
- Закрытый. При таком сценарии питтинг захватывает сперва внутреннюю поверхность металлической пленки. Распространение коррозии обычно идет в виде коротких линий или широких окружностей среднего диаметра (5-15 мм). Данный сценарий встречается достаточно редко. Он является самым губительным и опасным в связи со сложностью его своевременного обнаружения. Такая коррозия проявляется на поверхности только на позднем этапе роста ржавчины, когда спасти металл уже невозможно.
Турка
Кофейные турки изготавливаются из медного сплава, который часто подвергается окислению и потускнению. Есть несколько методик, которые на практике больше всего подходят для очистки турки. Все варианты требуют применения исключительно подручных средств.
Уксус и соль
Смесь эссенции и соли наносят на турку, втирают и смывают водой. Важным условием является растворение соли в жидкости, поскольку нерастворенные гранулы могут оставить царапины на покрытии.
Молочная сыворотка
Разбавив в стакане молочной сыворотки пару ложек соли, получают раствор для удаления окислов с медной турки. В жидкости смачивают мягкую ткань либо губку и натирают изделие со всех сторон. Закончив обработку, смывают остатки сыворотки под напором воды и насухо протирают.
Лимонная кислота
Использование лимонной кислоты подходят для устранения окислов, пятен и восстановления блеска. Чтобы восстановить блеск турки для кофе, нужно:
- растворить в 2 стаканах теплой воды 4 ложки кислоты;
- перелить жидкую смесь в глубокую емкость и погрузить внутрь турку;
- подождать 10 минут для размягчения грязи;
- протереть поверхность щеткой либо тряпкой.
Рассол
Для очистки медной турки рассолом его наносят на изделие и оставляют на 3-4 минуты. Эффект достигается при использовании любого рассола, например, от огурцов либо квашеной капусты. После полировки следы рассола смывают и вытирают турку мягкой тканью.
Сухая чистка
Метод сухой чистки предполагает использование мягких абразивных веществ и применяется в случае сильных загрязнений. В качестве абразивов используют меловую крошку либо муку грубого помола. Абразив в сухом виде наносят на фланелевую салфетку и полируют турку круговыми движениями.
Свойства меди
Медь – это самый первый металл, который стал использовать человек. Она золотистого цвета, а на воздухе покрывается оксидной пленкой и приобретает красно-желтый цвет, что отличает ее от других металлов, имеющих серый оттенок. Она очень пластична, обладает высокой теплопроводностью, считается отличным проводником, уступая только серебру. В слабой соляной кислоте, пресной и морской воде коррозия меди незначительная.

На открытом воздухе происходит окисление металла с образованием оксидной пленки, защищающей металл. Со временем она темнеет и становится коричневого цвета. Слой, покрывающий медь, называют патиной. Он изменяет свой цвет от коричневатого оттенка до зеленого и даже черного.
Историческая справка, характеристика меди
Медь относится к отряду основных химических элементов. В естественном (чистом) виде это металл с красно-оранжевым оттенком. Его используют для изготовления очень большого ряда изделий, к которым относятся провода электрические, посуда, трубы, радиаторы автомобилей и т. п.
Информация археологов говорит о том, что медь начали использовать более десяти тысяч лет назад. Так медный кулон, обнаруженный в северных районах современного Ирака, был изготовлен около 8700 года до нашей эры.

Медь обладает высокими показателями тепловой и электрической проводимости, легко обрабатывается как горячим, так и холодным способом. У нее очень высокая коррозийная стойкость. Это обусловлено тем, что медь создает на своей поверхности очень тонкий оксидный защитный слой в результате реакции ее с кислородом.
Медь нашла широкое применение в производстве акустических, электрических и иных проводов, присутствуя там как металл высокой чистоты либо с небольшими добавлениями серебра, мышьяка, фосфора, теллура, серы.





























