Процесс производства тугоплавкого вольфрама
 Этот материал относят к редким металлам. Для него характерны сравнительно небольшие объёмы потребления и производства, а также в земной коре малая распространённость. Никакой из редких металлов не получают восстановлением из сырья. Изначально оно перерабатывается в соединение химическое. А ещё любая редкометаллическая руда перед переработкой подвергается дополнительному обогащению.
Этот материал относят к редким металлам. Для него характерны сравнительно небольшие объёмы потребления и производства, а также в земной коре малая распространённость. Никакой из редких металлов не получают восстановлением из сырья. Изначально оно перерабатывается в соединение химическое. А ещё любая редкометаллическая руда перед переработкой подвергается дополнительному обогащению.
Выделяют три главные стадии для получения редкого металла:
- Разложение руды. Извлекаемый металл отделяется от основной массы перерабатываемого сырья. Он концентрируется в осадке или растворе.
- Получение химического чистого соединения. Его выделение и очистка.
- Из полученного соединения выделяют металл. Так получают чистые материалы без примесей.
В процессе получения вольфрама тоже есть несколько стадий. Исходное сырьё — шеелит и вольфрамит. Обычно в их составе содержится от 0,2 до 2% вольфрама.
- Обогащение руды производится при помощи электростатической или магнитной сепарации, флотации, гравитации. В итоге получают концентрат вольфрамовый, который содержит примерно 55−65% ангидрида вольфрама. Контролируется в них и наличие примесей: висмута, сурьмы, меди, олова, мышьяка, серы, фосфора.
- Получение вольфрамового ангидрида. Он является сырьём для изготовления вольфрама металлического или же его карбида. Для этого проводится ряд процедур, таких как: выщелачивание спёка и сплава, разложение концентратов, получение вольфрамовой технической кислоты и прочие. В результате этих действий должен получиться продукт, который будет содержать в себе 99,9% трехокиси вольфрама.
- Получение порошка. В виде порошка чистый металл может быть получен из ангидрида. Для этого проводится восстановление углеродом или водородом. Углеродное восстановление проводится реже, потому что ангидрид насыщается карбидами и это приводит к хрупкости металла и ухудшению обработки. При получении порошка применяют специальные методы, которые позволяют контролировать форму и размер зёрен, гранулометрический и химический составы.
- Получение вольфрама компактного. В основном он в виде слитков или штабиков является заготовкой для изготовления полуфабрикатов: ленты, прутков, проволоки и прочих.
Сталь — понятие и ее характеристики
Сталь– является самым распространенным материалом для изготовления конструкций, деталей, механизмов и инструмента.К сталям относятся все сплавы железа и углерода, причем доля железа должна быть не менее 45 %, а доля углерода — менее 2,14 процента. Углерод, выстраиваясь в молекулярные структуры железа, повышает прочность и твердость, но делает сплав менее пластичным и ковким. Кроме углерода, в состав сплава входят металлы и неметаллы.К наиболее важным характеристикам сплава относятся:
- модуль сдвига;
- модуль упругости;
- плотность;
- коэффициент линейного расширения.
Разные сферы применения материалов требуют от них отличающихся друг от друга физических и химических свойств. Так, например, стальные сплавы с высоким модулем упругости применяют для производства пружин и амортизаторов рессорного типа. Эти свойства целенаправленно меняются в результате добавления различных присадок.

Плавление стали
Плотность стали, или УВ стали — одна из важнейших характеристик сплава. Исходя из нее, конструктор подсчитывает вес детали и общий вес изделия, логистика организует закупку и доставку сырья, заготовок и готовых изделий, экономисты определяют себестоимость.Вес стали определяется как произведение плотности на объем.
Сравнительная характеристика теплоемкости основных строительных материалов
Для того, чтобы сравнить теплоемкость наиболее популярных строительных материалов, таких дерево, кирпич и бетон, необходимо рассчитать величину теплоемкости для каждого из них.
В первую очередь нужно определиться с удельной массой дерева, кирпича и бетона. Известно, что 1 м3 дерева весит 500 кг, кирпича – 1700 кг, а бетона – 2300 кг. Если мы берем стенку, толщина которой составляет 35 см, то путем нехитрых расчетов получим, что удельная масса 1 кв.м дерева составит 175 кг, кирпича – 595 кг, а бетона – 805 кг. Далее выберем значение температуры, при которой будет происходить накопление тепловой энергии в стенах. Например, это будет происходить в жаркий летний день с температурой воздуха 270С. Для выбранных условий рассчитываем теплоемкость выбранных материалов:
- Стена из дерева: С=СудхmудхΔТ; Сдер=2,3х175х27=10867,5 (кДж);
- Стена из бетона: С=СудхmудхΔТ; Сбет=0,84х805х27= 18257,4 (кДж);
- Стена из кирпича: С=СудхmудхΔТ; Скирп=0,88х595х27= 14137,2 (кДж).
Из произведенных расчетов видно, что при одинаковой толщине стены наибольшим показателем теплоемкости обладает бетон, а наименьшим – дерево. О чем это говорит? Это говорит о том, что в жаркий летний день максимальное количество тепла будет накапливаться в доме, выполненном из бетона, а наименьшее – из дерева.
Этим объясняет тот факт, что в деревянном доме в жаркую погоду прохладно, а в холодную погоду тепло. Кирпич и бетон легко накапливают в себе достаточно большое количество тепла из окружающей среды, но так же легко и расстаются с ним.
Самый тугоплавкий металл в мире — свойства, получение, применение
Определение «тугоплавкие металлы» не требует дополнительных пояснений в силу исчерпывающей информативности самого термина. Единственным нюансом остается пороговая температура плавления, после которой вещество можно считать тугоплавким.
Где применяется вольфрам?
Широко используют соединения вольфрама. Их применяют в машиностроительной и горнодобывающей промышленностях, для бурения скважин. Из данного металла благодаря его высокой прочности и твердости изготавливают детали двигателей летательных аппаратов, нити накаливания, артиллерийские снаряды, сверхскоростные роторы гироскопов, пули и т.д. Также вольфрам успешно применяется как электрод при аргонно-дуговой сварке. Не обходятся и такие отрасли промышленности без соединений вольфрама – текстильная, лакокрасочная.
Определение
Большинство определений термина тугоплавкие металлы
определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, чтобы металлы имели температуру плавления выше 4,000°F (2,200°C ). Это необходимо для их определения как тугоплавких металлов.
Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные, в то время как более широкое определение этих металлов позволяет включить в этот список ещё и элементы имеющие температуру плавления 2123 K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий.
Трансурановые элементы (которые находятся за ураном, все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам.
Сравнительная таблица степени тугоплавкости чистых металлов
Следует отметить, что тугоплавкие материалы не ограничиваются исключительно металлами. К этой категории относится ряд соединений – сплавы и легированные металлы, разработанных, чтобы улучшить определенные характеристики исходного материала.
Относительно чистых элементов, можно привести наглядную таблицу степени их температурной устойчивости. Возглавляет ее самый тугоплавкий металл, известный на сегодня, – вольфрам с температурой плавления 3422 0С. Такая осторожная формулировка связана с попытками выделить металлы, обладающие порогом расплава, превосходящим вольфрам.
Поэтому вопрос, какой металл самый тугоплавкий, может в будущем получить совсем иное определение.
https://youtube.com/watch?v=d9060b-BaPA
Пороговые величины остальных соединений приведены ниже:
- рений 3186;
- осмий 3027;
- тантал 3014;
- молибден 2623;
- ниобий 2477;
- иридий 2446;
- рутений 2334;
- гафний 2233;
- родий 1964;
- ванадий 1910;
- хром 1907;
- цирконий 1855;
- титан 1668.
Остается добавить еще один интересный факт, касающийся физических свойств жапропрочных элементов. Температура плавления некоторых из них чувствительная к чистоте материала. Ярким примером этому выступает хром, температура плавления которого может варьироваться от 1513 до 1920 0С, в зависимости от химического состава примесей. Поэтому, данные интернет пространства часто разнятся точными цифрами, однако качественная составляющая от этого не страдает.
Хром в чистом виде
Свойства самых тугоплавких металлов
Так самый тугоплавкий металл в мире (вольфрам) обычно легируется рением, торием, никелем при участии меди и/или железа. Первый делает сплав более коррозионстойким, второй — более надежным, а третий — придает небывалую плотность
Следует обратить внимание, что во всех сплавах вольфрама содержится не более 4/5
Из-за того, что вольфрам одновременно и твердый, и тугоплавкий его обычно применяют в электроснабжении, строении приборов, изготовлении оружия, снарядов, боеголовок и ракет. Более плотные сплавы (на базе никеля) применяют для производства клюшек для игры в гольф. Вольфрам образует и так называемые псевдосплавы. Дело в том, что в них металл не легируется, а наполняется жидким серебром или медью.
За счет разницы в температурах расплава получаются лучшие тепло и электропроводные свойства.
Это дает возможность использовать его для изготовления форм для литья цинковых деталей. Особое направления использования молибдена — в качестве легирующего элемента в стальных сплавах. Сплавы сталь+молибден обладают хорошей износостойкостью и невысокими показателями трения.
Сталь+молибден применяют в для изготовления труб, трубных конструкций, автомобиле и машиностроении.
Марки вольфрама
- ВЧ – чистый вольфрам, в котором отсутствуют какие-либо присадки;
- ВА – металл, имеющий в своем составе алюминиевую и кремнещелоную присадку, которые наделяют его дополнительными свойствами;
- ВМ – металл, имеющий в своем составе ториевую и кремнещелочную присадку;
- ВТ – вольфрам, в составе которого содержится оксид тория в качестве присадки, что существенно повышает эмиссионные свойства металла;
- ВИ – металл, содержащий оксид иттрия;
- ВЛ – вольфрам с окисью лантана, что также повышает эмиссионные свойства;
- ВР – сплав рения и вольфрама;
- ВРН – какие-либо присадки в металле отсутствуют, однако могут присутствовать примеси в больших объемах;
- МВ – сплав вольфрама с молибденом, что существенно повышает прочность после отжига, сохраняя при этом пластичность.
Применение сплавов вольфрама
Вольфрам способен образовывать сплавы с кобальтом, железом, никелем и другими металлами. Как уже было сказано, вольфрам может вступать в реакции с различными химическими элементами и тем самым устранять негативное действие некоторых из них (серы, фосфора) в сплавах. В результате получаем вольфрамовые сплавы — твердые, химически стойкие и упругие.
К примеру, сплавы вольфрама с бором и углеродом по твердости очень близки к алмазам- самым твердым минералам.
Некоторые сплавы пригодны для производства деталей, которые можно использовать для работы при повышенных температурах. Сплавы вольфрама с молибденом применяют для производства сопел реактивных самолётов и проволоки. Военная промышленность активно использует тяжелые сплавы вольфрама для создания танков, гранат, оружия, снарядов. Вольфрам стал отличной заменой свинца в данной сфере.
Мы перечислили основные сферы и области применения вольфрама, и, как видно, этот химический элемент остается востребованным на протяжении многих лет в самых разных отраслях промышленности. Уникальные свойства вольфрама говорят о том, что в будущем он может стать популярнее вдвойне и его станут использовать в совершенно новых сферах.
Плотность стали конструкционной легированной
Конструкционные легированные сплавы применяются в производстве высоконагруженных ответственных конструкций, в том числе работающих в агрессивных средах. Плотность марки 30ХГСА близка к стандартному значению в 7,85 т/м3плотность стали конструкционной низколегированной для сварных конструкций
Низколегированные сплавы обладают прекрасной свариваемостью и высокой стойкостью к коррозии, поэтому их широко применяют для ответственных конструкций в строительстве и кораблестроении. УВ стали этой группы колеблется в пределах 7,85-7,87 т/м3 и приведен в таблице:
| Группа | Марка | Плотность |
| низколегированная конструкционная | 09Г2С | 7,85 |
| высоко-углеродистая | 70 (ВС и ОВС) | 7,85 |
| среднеуглеродистая | 45 | 7,85 |
| мало-углеродистая | 10, 10А, 20, 20А | 7,85 |
| углеродистая конструкционная | Ст3сп, Ст3пс | 7,87 |
Примечания[ | ]
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 12345 Tungsten: physical properties (англ.). WebElements. Дата обращения 17 августа 2013.
- CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — P. 6-134. — 2828 p. — ISBN 1420090844.
- См. обзор измерений в: Tolias P. (2017), Analytical expressions for thermophysical properties of solid and liquid tungsten relevant for fusion applications, arΧiv:1703.06302
- ↑ 1234Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 418. — 623 с. — 100 000 экз.
- Теплофизические свойства вольфрама
- Большая советская энциклопедия Гл. ред. А. М. Прохоров. — 3-е изд. — М. : Сов. энцикл., 1969 – 1978
- Титан — металл будущего (рус.).
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 347.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 348.
- Brian Wheeler. Tungsten Shielding Helps at Fukushima Daiichi(неопр.) . Power Engineering Magazine (1 июля 2011).
- Murata Taisuke, Miwa Kenta, Matsubayashi Fumiyasu, Wagatsuma Kei, Akimoto Kenta, Fujibuchi Toshioh, Miyaji Noriaki, Takiguchi Tomohiro, Sasaki Masayuki, Koizumi Mitsuru. Optimal radiation shielding for beta and bremsstrahlung radiation emitted by 89Sr and 90Y: validation by empirical approach and Monte Carlo simulations // Annals of Nuclear Medicine. — 2014. — 10 мая (т. 28, № 7). — С. 617—622. — ISSN 0914-7187. — doi:10.1007/s12149-014-0853-6. []
- Kobayashi S., Hosoda N., Takashima R. Tungsten alloys as radiation protection materials // Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. — 1997. — Май (т. 390, № 3). — С. 426—430. — ISSN 0168-9002. — doi:10.1016/S0168-9002(97)00392-6. []
- Soylu H. M., Yurt Lambrecht F., Ersöz O. A. Gamma radiation shielding efficiency of a new lead-free composite material // Journal of Radioanalytical and Nuclear Chemistry. — 2020. — 17 марта (т. 305, № 2). — С. 529—534. — ISSN 0236-5731. — doi:10.1007/s10967-015-4051-3. []
- по данным «Цены на вольфрам»
- Федонкин М. А. Сужение геохимического базиса жизни и эвкариотизация биосферы: причинная связь // Палеонтологический журнал. — 2003. — № 6. — С. 33—40
- ↑ 12Audi G., Kondev F. G., Wang M., Huang W. J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2020. — Vol. 41, iss. 3. — P. 030001-1—030001-138. — doi:10.1088/1674-1137/41/3/030001. — Bibcode: 2017ChPhC..41c0001A.
- F. A. Danevich et al. α activity of natural tungsten isotopes (англ.) // Phys. Rev. C : journal. — 2003. — Vol. 67. — P. 014310. — doi:10.1103/PhysRevC.67.014310.
- C. Cozzini et al. Detection of the natural α decay of tungsten (англ.) // Phys. Rev. C : journal. — 2004. — Vol. 70. — P. 064606. — doi:10.1103/PhysRevC.70.064606.
Свойства вольфрама

Вольфрам – это металл переходного типа серого цвета светлых оттенков. Является одним из самых тугоплавких металлов. По виду похож на сталь. Механической обработке данный элемент поддается только при нагреве, которая в свою очередь, зависит от типа обработки.
Если рассматривать данный вид металлов с точки зрения применения материала, то, из его наиболее выдающийся характеристик стоит выделить:
Из минусов, ограничивающих применение, вольфрам обладает высокой ломкостью при низких температурах, большой плотностью, а также низкой сопротивляемости кислотам при малых температурах.
Свойства вольфрама (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Вольфрам |
| 102 | Прежнее название | |
| 103 | Латинское название | Wolframium |
| 104 | Английское название | Tungsten |
| 105 | Символ | W |
| 106 | Атомный номер (номер в таблице) | 74 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1781 г., Хуан Хосе Эльхуяр Любизе и Фаусто де Эльхуяр, Испания, 1783 г. |
| 110 | Год открытия | 1783 г. |
| 111 | Внешний вид и пр. | Твёрдый, тугоплавкий, блестящий серебристо-серый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-вольфрам с кубической объёмно-центрированной кристаллической решёткой,
– β-вольфрам с кубической кристаллической решёткой, именуемой фаза А15 |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000012 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 183,84(1) а. е. м. (г/моль) |
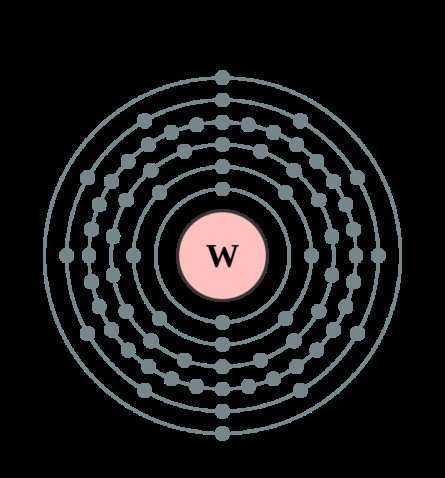
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O12 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 193 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 162 пм |
| 207 | Радиус иона (кристаллический) | W4+ 80 (6) пм,
W5+ 76 (6) пм, W6+ 74 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 74 электрона, 74 протона, 110 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 758,76 кДж/моль (7,86403(10) эВ) |
| 305 | Электродный потенциал | W3+ + 3e– → W, Eo = +0,11 В, W6+ + 6e– → W, Eo = +0,68 В |
| 306 | Энергия сродства атома к электрону | 78,6 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 19,3 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 17,6 г/см3 (при температуре плавления 3422 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 3422 °C (3695 K, 6192 °F) |
| 403 | Температура кипения* | 5930 °C (6203 K, 10706 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 52,31 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 774 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,114 Дж/г·K (при 0-1000 °C) |
| 410 | Молярная теплоёмкость | 24,27 Дж/(K·моль) |
| 411 | Молярный объём | 9,53 см³/моль |
| 412 | Теплопроводность | 173 Вт/(м·К) (при стандартных условиях), 162,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-вольфрам |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,160 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 310 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-33-7 |
Примечание:
205* Эмпирический радиус вольфрама согласно и составляет 139 пм и 137 пм соответственно.
206* Ковалентный радиус вольфрама согласно и составляет 162±7 пм и 170 пм соответственно.
401* Плотность вольфрама согласно и составляет 19,25 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 19,32 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления вольфрама согласно составляет 3420 °C (3693,15 K, 6188 °F).
403* Температура кипения вольфрама согласно и составляет 5555 °C (5828 K, 10031 °F) и 5680 °C (5953,15 K, 10256 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) вольфрама согласно составляет 61,5 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) вольфрама согласно и составляет 824 кДж/моль и 769 кДж/моль соответственно.
Почему твердое тело становится жидким?
Но давайте для начала разберем, как происходит сам процесс плавления на атомно-молекулярном уровне. Как мы знаем, в любом твердом теле все атомы и молекулы находятся четко и упорядочено в узлах
кристаллической решетки, благодаря этому твердое тело и является твердым.
Но что происходит, если мы начинает это самое гипотетическое твердо тело сильно нагревать – под действием температуры атомы и молекулы резко увеличивают свою кинетическую энергию и по достижении определенных критических значений, они начинают покидать кристаллическую решетку, вырываться из нее. А само твердое тело начинает буквально распадаться, превращаясь в некое жидкое вещество – так происходит плавление.
При этом процесс плавления происходит не резким скачком, а постепенно. Также стоит заметить, что плавление относится к эндотермическим процессам, то есть процессам, при которых происходит поглощение теплоты.
Процесс обратный к плавлению называют кристаллизацией – это когда тело из жидкого состояния наоборот превращается в твердое. Если вы оставите воду в морозилке, она через какое-то время превратится в лед – это самый типичный пример кристаллизации из реальной жизни.
Основные характеристики вольфрама
Для практического применения наиболее важны высокие показатели следующих характеристик:
электрическое сопротивление;
коэффициент линейного расширения;
температура плавления.
Чистый вольфрам обладает высокой пластичностью, не растворяется в специальном кислотном растворе без предварительного нагрева хотя бы до 5000С. Он легко вступает в реакцию с углеродом, следствием которой является образование карбида вольфрама известного высокой прочностью. Также металл известен своими оксидами, наиболее распространенный из них вольфрамовый ангидрид. Его главное преимущество над остальными, возможность восстановления порошка к состоянию компактного металла, с побочным образованием низших оксидов.

Режущие пластины фирмы Sandvik Coromant с применением карбида вольфрама
Среди основных характеристик, делающих применение вольфрама затруднительным называют следующие:
высокая плотность;
ломкость и склонность к окислению при низких температурах.
Кроме того, высокая температура кипения, а также точка испарения затрудняют добычу компактного материала.
Это интересно: Теплопроводность металлов и сплавов — объясняем по полочкам
Применение[ | ]
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам
Нить накаливания
- Тугоплавкость вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргонно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
- Высокая плотность вольфрама делает его удобным для защиты от ионизирующего излучения. Несмотря на бо́льшую плотность по сравнению с традиционным и более дешёвым свинцом, защита из вольфрама оказывается менее тяжёлой при равных защитных свойствах или более эффективной при равном весе. Из-за тугоплавкости и твёрдости вольфрама, затрудняющих его обработку, в таких случаях используются более пластичные сплавы вольфрама с добавлением никеля, железа, меди и др. либо взвесь порошкообразного вольфрама (или его соединений) в полимерной основе.
Соединения вольфрама
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам.
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
- Некоторые соединения вольфрама применяются как катализаторы и пигменты.
- Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
- Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К).
Другие сферы применения
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
ПРОИСХОЖДЕНИЕ
 Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Также есть месторождения вольфрама в Армении и других странах.
СТРУКТУРА
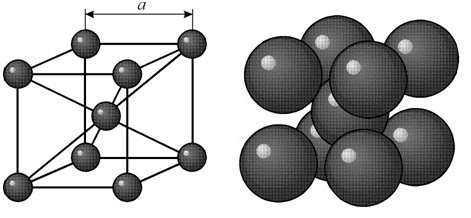
Кристалл вольфрама имеет объемноцентрированную кубическую решетку. Кристаллы вольфрама на холоду отличаются малой пластичностью, поэтому в процессе прессования порошка они практически почти не изменяют своей основной формы и размеров и уплотнение порошка происходит главным образом путем относительного перемещения частиц.
В объемно-центрированной кубической ячейке вольфрама атомы располагаются по вершинам и в центре ячейки, т.е. на одну ячейку приходится два атома. ОЦК-структура не является плотнейшей упаковкой атомов. Коэффициент компактности равен 0,68. Пространственная группа вольфрама Im3m.
Биологическая роль
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни.
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.
Биологическая роль
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни.
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.
Сфера применения AISI 304
Нержавеющая сталь AISI 304 без проблем переносит высокотемпературный режим эксплуатации, имеет хорошие прочностные характеристики и отличается повышенной стойкостью к окислению, чем объясняется широкий спектр ее применения.
Материал востребован в следующих отраслях:
- текстильной, бумажной;
- фармакологической, химической;
- молочной, пищевой, пивоваренной;
- медицинской (производство игл, хирургических инструментов);
- судостроительной (выпуск оборудования, крепежей для атомных судов);
- горнодобывающей, нефтяной (фильтрационные сетки для скважин);
- металлопрокатной (изготовление листов, труб, шестигранников и пр.).
Превосходные параметры стали AISI 304 позволяют производить из нее оборудование и конструкции для эксплуатации в условиях агрессивного химического воздействия. Готовые изделия демонстрируют высокую прочность и имеют длительный срок службы. Еще одним важным плюсом материала является гигиеничность и эстетичный вид, поэтому из нее изготавливаются:
- столовые приборы;
- кухонная мебель;
- криогенные сосуды;
- арматура для сантехнического оборудования;
- емкости, предназначенные для работы под давлением;
- катушки охлаждения и холодильное оборудование;
- контейнеры, резервуары для сухих и жидких веществ и т.д.