Немного общих сведений
В народе довольно популярным является слово «ржавчина», которое относится к процессу коррозии металла и различных сплавов. К полимерам люди используют понятия “старение”. По факту эти слова являются синонимами. Ярким примером можно назвать старение резиновых продуктов, которые активно взаимодействуют с кислородом. Некоторые пластиковые изделия из-за осадков могут быстро приходить в негодность. То, насколько быстро будет происходить процесс коррозии, полностью зависит от условий, в которые помещено изделие. Особенно влияет влажность окружающей среды. Чем больше ее показатель, тем быстрее металл станет непригодным к использованию. Опытным путем учеными было установлено, что около 10 % изделий на производстве просто списывается из-за коррозии. Виды данного процесса различные, их классификация зависит от типа среды, в которой изделия находятся, скорости и характера протекания. Далее рассмотрим более подробно типы коррозии. Теперь каждый человек должен понимать, что такое коррозия металла.

Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия.
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия.
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия.
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Катодная защита
Реализация принципа катодной защиты может осуществляться одним из двух способов. Первый — подача отрицательного потенциала может происходить от специального источника электроэнергии, именуемого станцией катодной защиты.
При использовании катодных станций может возникнуть следующая проблема.
Электричество для установки требуемого потенциала нередко подается по длинному кабелю. Этот кабель подвержен действию молнии и некоторым другим электромагнитным влияниям. Для того, чтобы в результате не произошло перенапряжения, рекомендуется использовать комплексное решение ZANDZ.
Коррозионное растрескивание под напряжением в хлоридсодержащих средах
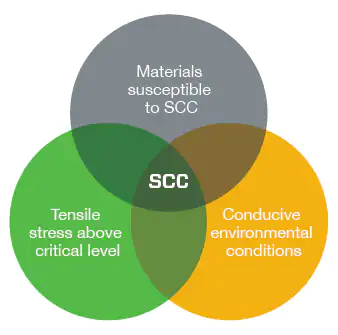
Опасность коррозионного растрескивания под напряжением в том, что оно может стать причиной разрушения компонента при уровне напряжения ниже предела текучести сплава. В присутствии ионов хлора аустенитные нержавеющие стали подвержены коррозионному растрескиванию под напряжением. Ионы вступают во взаимодействие с материалом в верхней части трещины, где растягивающие напряжения имеют наивысшее значение, что создает благоприятные условия для роста трещины. Это явление бывает трудно обнаружить, а окончательное разрушение может произойти внезапно.
Причины образования
Чтобы произошло коррозионное растрескивание под напряжением, требуется одновременное соблюдение трех условий.
- Металл должен быть уязвим для коррозионного растрескивания под напряжением.
- Должны присутствовать внешние факторы (поток жидкости / газа или температура), способствующие коррозионному растрескиванию под напряжением.
- Растягивающее напряжение (приложенное + остаточное) должно превышать критический уровень.
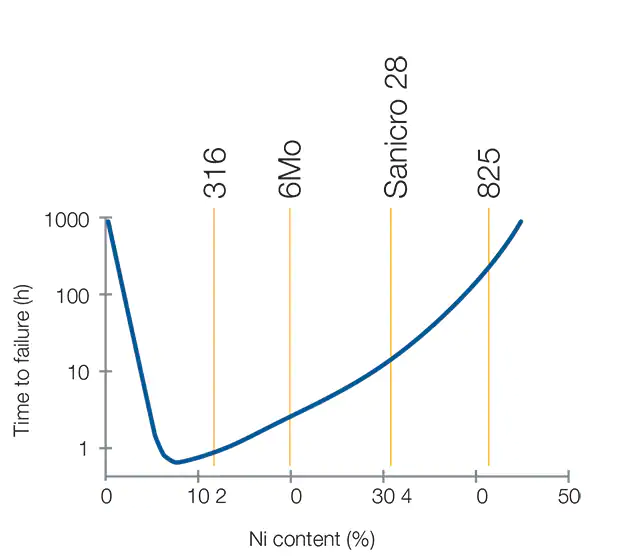
Более высокое содержание никеля означает более высокую стойкость материала к SCC под воздействием хлоридов.
Рекомендации
Советы:
- На защите деталей лучше не экономить, и покрыть их резиновой или полимерной краской.
- Перед использованием абразивов нужно попробовать удалить ржавчину щадящими составами.
- Сложные коррозионные процессы можно останавливать с помощью агрессивных химикатов, но прежде чем их использовать, нужно изучить свойства состава, характеристики металла, чтобы предотвратить возможные негативные реакции.
Коррозионные процессы могут быстро разрушить любой материал. Порча металлоконструкций в некоторых ситуациях может иметь катастрофические последствия. Изучив способы защиты от образования коррозии, нужно применить один из наиболее подходящих.
Коррозия в неэлектролитных жидкостях
Общие сведения
К жидким неэлектропроводным средам (а точнее, неэлектролитным жидкостям) можно отнести такие органические вещества, к примеру:
- Керосин.
- Бензол.
- Бензин.
- Хлороформ.
- Нефть.
- Спирты.
- Фенол.
- Тетрахлорид углерода.
Еще к таким жидкостям причисляют малое количество жидкостей неорганического типа, к примеру, жидкий бром и сера, которая расплавлена. При этом следует отметить, что растворители органического типа сами по себе не будут вступать в реакцию с металлами, но, при наличие маленького объема примесей появляется интенсивный процесс взаимодействий. Скорость коррозии увеличивают находящиеся в нефти элементов с содержанием серы.
Также, для усиления коррозийных процессов нужны высокие температуры. Влага будет интенсифицировать развитие коррозии по электромеханическому принципу. Еще одним фактором быстрого коррозийного развития – бром в жидком виде. При нормальной температуре он особенно разрушительно будет воздействовать на высокоуглеродистые стали, титан и алюминий. Менее существенно воздействие брома на никель и железо, а самую большую устойчивость к жидкому типу брома будут показывать тантал, свинец, платина и серебро.
Расплавленная сера будет вступать в агрессивные реакции практически со всеми металлами, и в первую очередь с оловом, свинцом и медью. На углеродистые марки титан и стали сера будет влиять меньше, а еще практически полностью разрушает алюминий. Защитные действия для металлических конструкций, которые находятся в неэлектропроводных средах жидкого типа, проводят добавлением устойчивым к определенной среде металлом (к примеру, сталей с большим содержанием хрома). Еще используются особые защитные покрытия (к примеру, в среде, где есть много серы, применяют алюминиевые покрытия).
Способы защиты от коррозии
Способы борьбы с коррозией будут включать в себя:
-
Обработку главного металла защитным слоем (например, нанесение лакокрасочного материала).
- Применение ингибиторов (арсенитов или хроматов).
- Внедрение материалов, которые устойчивые к коррозийным процессам.
Подбор определенного материала будет зависеть от потенциальной эффективности (тут имеется виде финансовой и технологической) ее применения.
Современные принципы по защите металла от химической коррозии металла будут основаны на следующих методиках:
- Улучшение споротивляемости химического типа. Себя смогли успешно зарекомендовать устойчивые материалы (стекло, высокополимерный пластик и керамика).
- Изоляция материала от агрессивных сред.
- Уменьшение агрессивности технологической среды – в роли примеров таких действий можно выполнить нейтрализацию и удалить кислотность в коррозионой среде, а еще применять различные ингибиторы.
- Защита электрохимического типа (накладывание внешнего тока).
Указанные методики будут подразделяться на две группы:
- Повышение сопротивляемости химического типа и изолирование будет применяться до того, как металлическая конструкция запускается в использовании.
- Уменьшение агрессивности и защиты электрохимического типа применяется уже при применении изделий и металла. Использование обеих методик дает возможность внедрять новые защитные методы, и в результате защита будет обеспечиваться изменением эксплуатационных условий.
Одним из самых часто используемых методов защиты металла является антикоррозийное гальваническое покрытие, но это экономически нерентабельно при большой площади поверхности. Причина в больших тратах на процесс подготовки. Ведущее место среди методов по защите будет занимать покрытие металла лакокрасочным материалом.
И все-таки, окрашенная поверхность защищает металлы от процессов коррозии даже при локальном повреждении пленки, тогда как несовершенные покрытия гальванического типы способны даже ускорить коррозию.
Электрохимическая коррозия и ее особенности
При электрохимической коррозии разрушение материала происходит из-за его прикосновения к электролиту. В качестве последнего вещества может быть конденсат, дождевая вода. Нужно заметить, что чем больше будет солей в жидкости, тем выше показатель электропроводности. Соответственно, процесс коррозии будет протекать довольно быстро. Если говорить о наиболее популярных местах, которые поддаются коррозии, нужно отметить заклепки в металлической конструкции, сварные соединения, а также просто места, в которых материал поврежден. Бывает так, что сплав железа при его создании покрыт специальными веществами, которые имеют антикоррозионные свойства. Однако это не предотвращает процесс ржавения, а лишь его замедляет. Довольно ярким примером можно назвать оцинковку. Цинк имеет отрицательный потенциал, если сравнивать с железом. Из-за этого последний материал будет восстанавливаться, а цинк повредится. Если на поверхности будет находиться оксидная пленка, то процесс разрушения станет длительным. Электрохимическая коррозия имеет несколько видов, но нужно отметить, что все они опасные и, как правило, остановить такой вид коррозии металлов невозможно.
Типы коррозии и описание процесса
- Химическая — это такой тип взаимного влияния металла с окружающей средой, в процессе действия которого окисление и дальнейшее восстановление части среды проходят в едином акте. Продукты взаимного влияния не имеют разделения в пространстве.
- Электрохимическая — это такой тип взаимного влияния металла с коррозийным пространством, в котором реакция ионизации коррозионной среды проходит в нескольких актах.
- Газовая— это коррозия металлических поверхностей при слабом содержании воды (обычно влаги находится не больше 0,2 %) либо при максимальных рабочих температурах. В современной химической и газовой промышленности подобный тип коррозии может встречаться чаще остальных.
- Атмосферная — это тип коррозии в воздушной атмосфере либо в среде влажного газа.
- Биокоррозия — это биологический тип коррозии металла, который протекает под воздействием жизнедеятельности микробов и разных микроорганизмов.
- Контактная — это такой тип коррозии, который провоцируется контактом нескольких типов металлов с различными стационарными потенциалами.
- Радиационная — это такой тип коррозии металла, который обусловлен влиянием радиоактивного облучения.
Также существует коррозия внешним или блуждающим электрическим током. Еще один тип коррозии — это коррозия под напряжением, которая спровоцирована одномоментным влиянием коррозионной среды и протеканием механического напряжения
Важно учитывать, что данный тип коррозии является очень вредным, в особенности для систем, испытывающих сильные физические нагрузки
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок),
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Способы борьбы с ржавчиной
Перед тем, как приступать к борьбе с коррозией, важно ознакомиться с наиболее популярными и эффективными методами удаления ржавчины
Механический способ удаления ржавчины
Если вы по определенным причинам не хотите или не можете использовать химические средства, вам подойдёт механический метод удаления коррозии.
Ручные щетки.
Если площадь поверхности, с которой требуется удалить ржавчину небольшая, то, как правило, используют ручные щетки с металлическим ворсом. Различаются они между собой способом крепления ручки и жесткостью проволоки. Некоторые модели щеток имеют проволоку, покрытую латунью. Такие щетки считаются наиболее эффективными, поэтому специалисты советуют применять их для борьбы с коррозией.
Механические щетки.
Если у вас есть устройства, оснащённые пневматическим приводом, то можно очистить металл механическими щётками. Они могут быть как торцевыми, так и радиальными. Как правило, такие щетки устанавливают в электро-дрели или шуруповерт современного типа. Хотя, вам может показаться, что работать с механическими щётками просто, это отнюдь не так. В процессе работы инструмент сложно удержать, так как он постоянно вырывается из рук.
Алюминиевая фольга
Фольгу используют для удаления ржавчины на металлических поверхностях. Способ применения: разведите столовый уксус с теплой водой, обработайте фольгу получившимся раствором.
Удаление ржавчины с помощью химических средств
Столовый уксус
Если очистить от коррозии требуется небольшую металлическую деталь, то ее полностью помещают в раствор уксуса 9% на 20-30 минут. Затем достаньте из раствора и насухо протрите тряпкой. Если деталь большого размера, то очистить ее можно губкой смоченной в уксусе.
Важно: чтобы не повредить нежную кожу рук, работать необходимо в перчатках. Лимонная кислота
Лимонная кислота
Пищевая сода
Смешайте пищевую соду с водой, должна получиться кашеобразная консистенция. Нанесите полученную массу на ржавчину, оставьте на 30 минут, удалите остатки средства с помощью сухой тряпки.
«Кока-кола»
Газировка отлично справляется с ржавчиной. Способ применения: перелейте газированный напиток в емкость, поместите в нее металлическое изделие, оставьте на 24 часа. Затем промойте изделие, отрите сухой тряпкой.
Соляная кислота
Соляную кислоту применяют не только для устранения ржавого налета, но и для предотвращения появления коррозии. После обработки соляной кислотой на поверхности изделия создается защитный слой
Важно соблюдать правила техники безопасности работая с соляной кислотой
Перекись водорода
Перекись водорода не только удаляет коррозию с металлической поверхности, но и придает ей первоначальный блеск. Способ применения: смешайте 50 мл перекиси водорода с 200 мл нашатырного спирта. Затем добавьте компоненты в один литр воды, тщательно размешайте. Полученный раствор нанесите на участок, который требуется очистить. Средство оставьте на 25-30 минут, смойте теплой водой, тщательно протрите сухим полотенцем.
Что такое коррозия?
Слово «коррозия» происходит от латинского «corrodo – грызу». Встречаются ссылки и на позднелатинское «corrosio – разъедание». Но так или иначе:
Хотя коррозию чаще всего связывают с металлами, ей также подвергаются бетон, камень, керамика, дерево, пластмассы. Применительно к полимерным материалам, правда, чаще используется термин деструкция или старение.
Коррозия и ржавчина — не одно и то же
В определении коррозии абзацем выше не зря выделено слово «процесс». Дело в том, коррозию частенько приравнивают к термину «ржавчина». Однако это не синонимы. Коррозия — это именно процесс, в то время как ржавчина — один из результатов этого процесса.
Также стоит отметить, что ржавчина — продукт коррозии исключительно железа и его сплавов (таких как сталь или чугун). Поэтому, когда говорим «ржавеет сталь», то подразумеваем, что ржавеет железо в ее составе.

Если ржавчина относится только к железу, значит другие металлы не ржавеют? Не ржавеют, но это не значит, что они не корродируют. Просто продукты коррозии у них другие.
Например, медь, корродируя, покрывается красивым по цвету зеленоватым налетом (патиной). Серебро на воздухе тускнеет — это на его поверхности образуется налет сульфида, чья тонкая пленка придает металлу характерную розоватую окраску.
 Патина — продукт коррозии меди и ее сплавов
Патина — продукт коррозии меди и ее сплавов
Механизм протекания коррозионных процессов
Разнообразие условий и сред, в которых протекают коррозионные процессы, очень широко, поэтому сложно дать единую классификацию встречающихся случаев коррозии. Но, несмотря на это, все коррозионные процессы имеют не только общий результат — разрушение металла, но и единую химическую сущность — окисление.
Упрощенно окисление можно назвать процессом обмена веществ электронами. Когда одно вещество окисляется (отдает электроны), другое, наоборот, восстанавливается (получает электроны).
Например, в реакции…
… атом цинка теряет два электрона (окисляется), а молекула хлора присоединяет их (восстанавливается).
Частицы, которые отдают электроны и окисляются, называются восстановителями, а частицы, которые принимают электроны и восстанавливаются, называются окислителями. Два этих процесса (окисление и восстановление) взаимосвязаны и всегда протекают одновременно.
Такие вот реакции, которые в химии называются окислительно-восстановительными, лежат в основе любого коррозионного процесса.
Склонность к окислению у разных металлов неодинакова. Чтобы понять, у каких она больше, а у каких меньше, вспомним школьный курс химии. Было там такое понятие как электрохимический ряд напряжений (активности) металлов, в котором все металлы расположены слева направо в порядке повышения «благородности».
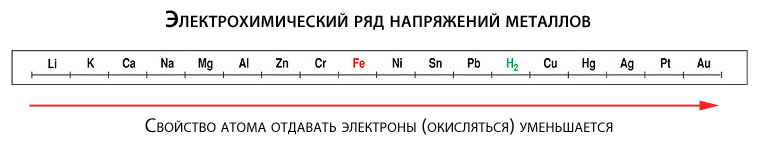
Так вот, металлы, расположенные в ряду левее, более склонны к отдаче электронов (а значит и к окислению), чем металлы, стоящие правее. Например, железо (Fe) больше подвержено окислению, чем более благородная медь (Cu). Отдельные металлы (например, золото), могут отдавать электроны только при определенных экстремальных условиях.
К ряду активности вернемся немного позже, а сейчас поговорим об основных видах коррозии.
Особенности защитных средств от ржавчины
При работе с металлом любой человек понимает, что перед тем как наносить защитные материалы, необходимо подготовить поверхность. Зачастую все трудности заключаются именно в этом этапе. Для того чтобы создать специальный барьер, который позволит ржавчине добираться до металла, необходимо ввести понятие компаунда. Благодаря ему в комплекте сформируется защита от коррозии. При этом имеет место электроизоляция. Обычно довольно сложно защищаться от коррозии черных металлов.
Из-за специфики использования различных средств для защиты необходимо понимать условия эксплуатации материала. Если металл будет располагаться под землей, то необходимо использовать многослойные покрытия, которые будут иметь не только антикоррозионные свойства, но и усиленную защиту от механических повреждений. Если речь идет о коммуникациях, которые активно взаимодействуют с кислородом и газами, следует использовать средство, минимизирующее воздействие воды и кислорода
Соответственно, повышенное внимание со стороны производителя будет уделяться изоляции от влаги, пара и низких температур. В таком случае следует добавлять присадки и специальные пластификаторы, ведь причины коррозии металлов различны и защищаться следует от всех видов





























